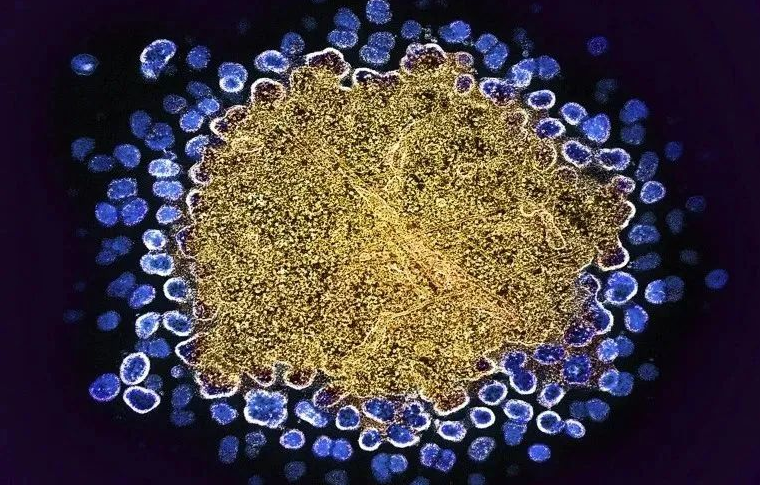
近期,国际医学界公布了一项关于HIV治疗的重要进展:科学家通过干细胞移植技术结合基因编辑方法,进一步拓展了HIV治愈的可能性。这一成果不仅挑战了以往对CCR5基因突变作为唯一治愈靶点的认知,还为基因疗法和免疫重建策略提供了关键启示。 突破性技术:干细胞移植与基因编辑的协同作用 传统观点认为,治愈HIV需依赖携带双份CCR5Δ32纯合突变的干细胞移植,以阻断病毒进入免疫细胞的路径。然而,最新研究显示,即使供体仅携带单份CCR5突变基因,结合化疗与抗逆转录病毒治疗(ART)仍能有效清除病毒。例如,德国一名60岁患者在接受携带单份突变的干细胞移植后,已近六年未检测到HIV病毒复制。这一案例表明,病毒库的缩减(即体内潜伏HIV的免疫细胞被清除)可能比单纯阻断CCR5受体更为关键。 图:编码一种名为CCR5受体的基因的突变可以阻止HIV(蓝色)进入免疫细胞。图片来源:NIAID/美国国立卫生研究院/SPL 研究人员发现,移植前的化疗能大幅清除患者体内的病毒储存库,而供体干细胞则通过免疫排斥反应进一步消灭残留感染细胞。加利福尼亚大学圣迭戈分校的Sara Weibel指出,这种“三重策略”(ART+化疗+移植)为开发更安全的基因疗法奠定了基础。 基因编辑技术的临床潜力 基于CCR5靶点的基因编辑技术(如CRISPR-Cas9)正成为研究热点。北京大学团队曾通过CRISPR编辑造血干细胞中的CCR5基因,实现患者免疫系统的重建。而美国Excision BioTherapeutics公司开发的EBT-101疗法,则直接切割HIV整合的DNA片段,已在动物实验中取得显著效果。 澳大利亚墨尔本多尔蒂研究所的Sharon Lewin强调,即使基因编辑无法覆盖所有细胞,部分CCR5缺陷细胞仍能形成“抗病毒屏障”。此外,供体干细胞快速替代宿主细胞的过程,可能加速病毒库的清除。 挑战与未来方向 尽管干细胞移植风险高且仅适用于癌症患者,但其机制为基因疗法提供了重要线索。例如,欧洲约10%人群携带单份CCR5突变,大幅扩大了潜在供体范围。同时,针对“精英控制者”(自然抑制病毒复制的个体)的研究,揭示了免疫调控在治愈中的潜在作用。 目前,全球约4000万HIV感染者中,仅7例通过干细胞移植实现治愈。科学家正探索将基因编辑与免疫疗法结合,开发更安全、可普及的方案。正如柏林夏里特医学院的Christian Gaebler所言:“治愈HIV不再依赖单一靶点,而是需要多技术协同突破。” 文章标题:Seventh patient ‘cured’ of HIV: why scientists are excited 作者:Smriti Mallapaty DOI:https://doi.org/10.1038/d41586-024-02463-w 内容来源于:松鼠哥